Klinische Bewertung
Ein Medizinprodukt muss sicher sein und seinen klinischen Nutzen sowie die Leistung bei normaler, bestimmungsgemäßer Verwendung des Produktes erfüllen.
Die Darlegung dieser Punkte ist das Hauptziel der klinischen Bewertung. Sie ist daher essentieller Bestandteil der technischen Dokumentation und Voraussetzung für die Erfüllung der grundlegenden Sicherheits- und Leistungsanforderungen gemäß Anhang I der Verordnung (EU) 2017/745 (MDR).
Die klinische Bewertung ist unabhängig von der Risikoklasse eines Medizinprodukts zu erstellen, um die in Artikel 52 MDR genannten Konformitätsbewertungsverfahren abschließen zu können.
Sie ist ein systematischer und geplanter Prozess, welcher in einem klinischen Bewertungsplan (Clinical Evaluation Plan, CEP) festlegt wird. Der CEP legt dar, wie die klinischen Daten eines Medizinprodukts zu generieren, zusammenzustellen, zu analysieren und abschließend zu bewerten sind.
Die wissenschaftliche Auswertung und kritische Beurteilung werden im klinischen Bewertungsbericht (Clinical Evaluation Report, CER) zusammengefasst.
Dabei ist die klinische Bewertung immer als ein fortlaufender Prozess anzusehen, der sich über die gesamte Lebensdauer eines Medizinprodukts erstreckt.
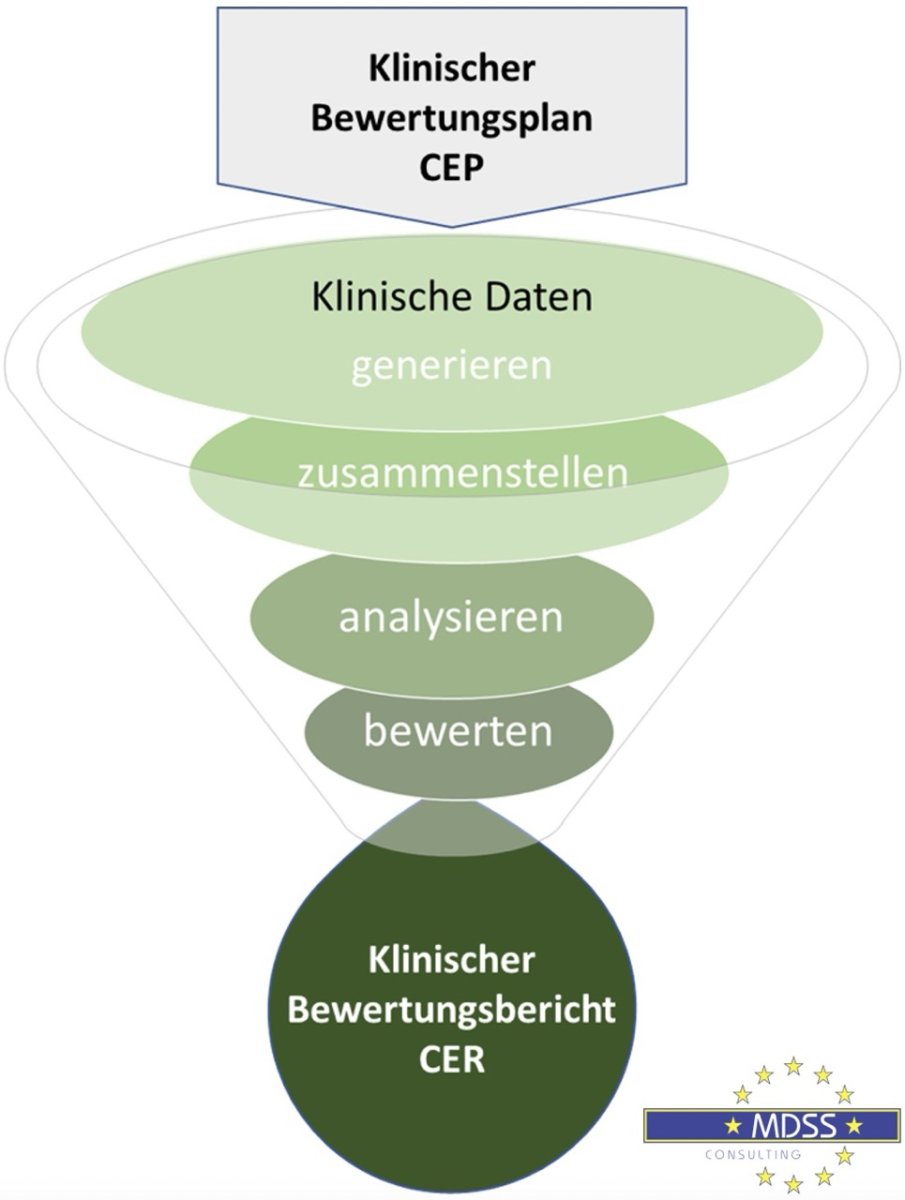
Abbildung: Prozess der klinischen Bewertung gem. Verordnung (EU) 2017/745 (MDR)
Regulatorische Anforderungen an eine klinische Bewertung
Mit der MDR haben sich die Vorgaben an die klinische Bewertung im Vergleich zur Medizinprodukterichtlinie 93/42/EWG (MDD) in vielerlei Hinsicht deutlich verschärft. Die Anforderungen sind in Artikel 61 sowie im Anhang XIV (Teil A) beschrieben.
Mehrere MDCG-Leitlinien (Guidelines der Europäischen Kommission) präzisieren diese Vorgaben und geben Hilfestellung bei der Erstellung bzw. Aktualisierung der klinischen Bewertung. Die in großen Teilen noch gültige Leitlinie MEDDEV 2.7/1 rev. 4 wird derzeit ebenfalls in eine MDCG-Leitlinie überführt. Zudem befindet sich zurzeit die ISO 18969 „Clinical evaluation of medical devices“ in Arbeit, welche allgemeine Terminologien, Prinzipien und Verfahren für die klinische Bewertung von Medizinprodukten festgelegt. Die Regelwerke sollen helfen, die mit einem Produkt verbundenen klinischen Risiken einzuschätzen und die Akzeptanz dieser Risiken im Kontext des klinischen Nutzens bei bestimmungsgemäßer Verwendung des Produkts zu beurteilen.
Sind klinische Daten zur Darlegung der Sicherheit und Leistungsfähigkeit bzw. des klinischen Nutzens nicht in ausreichender Menge oder Güte vorhanden (z.B. in wissenschaftlicher Literatur) und müssen Hersteller diese Daten im Rahmen klinischer Prüfungen erheben, ist darüber hinaus die Norm „Klinische Prüfung von Medizinprodukten an Menschen – Gute klinische Praxis“ (EN ISO 14155) sowie das MPDG (Medizinprodukterecht-Durchführungsgesetz) zu beachten.
Unterstützung bei der klinischen Bewertung
Unter Berücksichtigung aller o.g. Aspekte kann die MDSS Consulting GmbH mit einem Team aus erfahrenen Experten Ihnen individuell bei der klinischen Bewertung Ihres Medizinprodukts helfen:
- Nutzen Sie unsere hilfreichen Vorlagen für den klinischen Bewertungsplan (CEP) und den klinischen Bewertungsbericht (CER)
- Eine Gap-Analyse im Rahmen der Aktualisierung einer bereits bestehenden klinischen Bewertung kann als erster Schritt hilfreich sein, um vorhandene Lücken sicher zu identifizieren und leichter füllen zu können.
- Sie benötigen eine Recherche der wissenschaftlichen Literatur für die klinische Bewertung? Wir unterstützen Sie gerne gemäß den Vorgaben Ihres klinischen Bewertungsplan.
- Auch bei einer umfassenden Überarbeitung einer klinischen Bewertung stehen wir für Sie zur Verfügung, sodass die klinische Bewertung auf dem neuesten Stand ist und den aktuellen Anforderungen gerecht wird.
- Gerne erstellen wir Ihnen auch die komplette klinische Bewertung neu, vom CEP bis zum CER, für Ihr Medizinprodukt ‒ für alle Risikoklassen.
Kontaktieren Sie uns einfach, damit wir mit Ihnen zusammen die individuell passende Lösung finden.
MDCG-Leitlinien im Kontext der MDR
Mit dem Übergang von der Richtlinie 93/42/EWG (MDD) zur Verordnung (EU) 2017/745 (MDR) wurden sukzessive die früheren MEDDEV-Dokumente, die unter der MDD galten, durch MDCG-Leitlinien ersetzt. Diese neuen Leitfäden bilden das grundlegende Regelwerk unter der MDR und IVDR. Obwohl diese Leitfäden keine rechtliche Bindung haben, wird dringend dazu geraten, sie bei der Auslegung und Umsetzung zu berücksichtigen.
Rolle und Bedeutung der MDCG
Die Medical Device Coordination Group (MDCG) wurde durch die MDR ins Leben gerufen und setzt sich aus mindestens einem und maximal zwei Experten aus jedem Mitgliedstaat zusammen, sowie maximal zwei Stellvertretern. Alle Mitglieder sind Experten im Bereich Medizinprodukte und In-vitro-Diagnostika und werden für eine Amtszeit von drei Jahren ernannt.
Die Hauptaufgaben der MDCG umfassen nicht nur die Erstellung von Leitlinien für die einheitliche Umsetzung der MDR, sondern auch die Überwachung des technischen Fortschritts, die Weiterentwicklung von Normen und Standards sowie die Bewertung von Benannten Stellen. Darüber hinaus bietet sie Unterstützung für zuständige Behörden in verschiedenen regulatorischen Bereichen. Die MDCG dient der Europäischen Kommission als Ansprechpartner für Details zur Arbeitsweise der Koordinationsgruppe für Benannte Stellen gemäß Artikel 49. Dies unterstreicht die erhebliche Rolle der MDCG bei der Umsetzung der Verordnung.
Die MDCG-Dokumente dienen der Unterstützung von Herstellern, Behörden, Benannten Stellen und anderen Akteuren bei der einheitlichen Auslegung und Anwendung der Anforderungen der Verordnungen – MDR sowie auch IVDR. Sie bieten nicht nur allgemeine Leitlinien, sondern auch konkrete Beispiele und Anleitungen. Da die MDCG-Leitfäden von Expertenarbeitsgruppen erstellt und von der Europäischen Kommission sowie der gemeinsamen Koordinierungsgruppe genehmigt werden, repräsentieren sie stets die gemeinsame Auslegung der Anforderungen durch die Behörden der Mitgliedstaaten. Daher kommt ihnen eine hohe Bedeutung zu.
