Klinische Daten für die klinische Bewertung
Für die klinische Bewertung müssen stetig neue relevante klinische Daten erhoben werden. Hierfür können zum Beispiel folgende Quellen eingeschlossen werden:
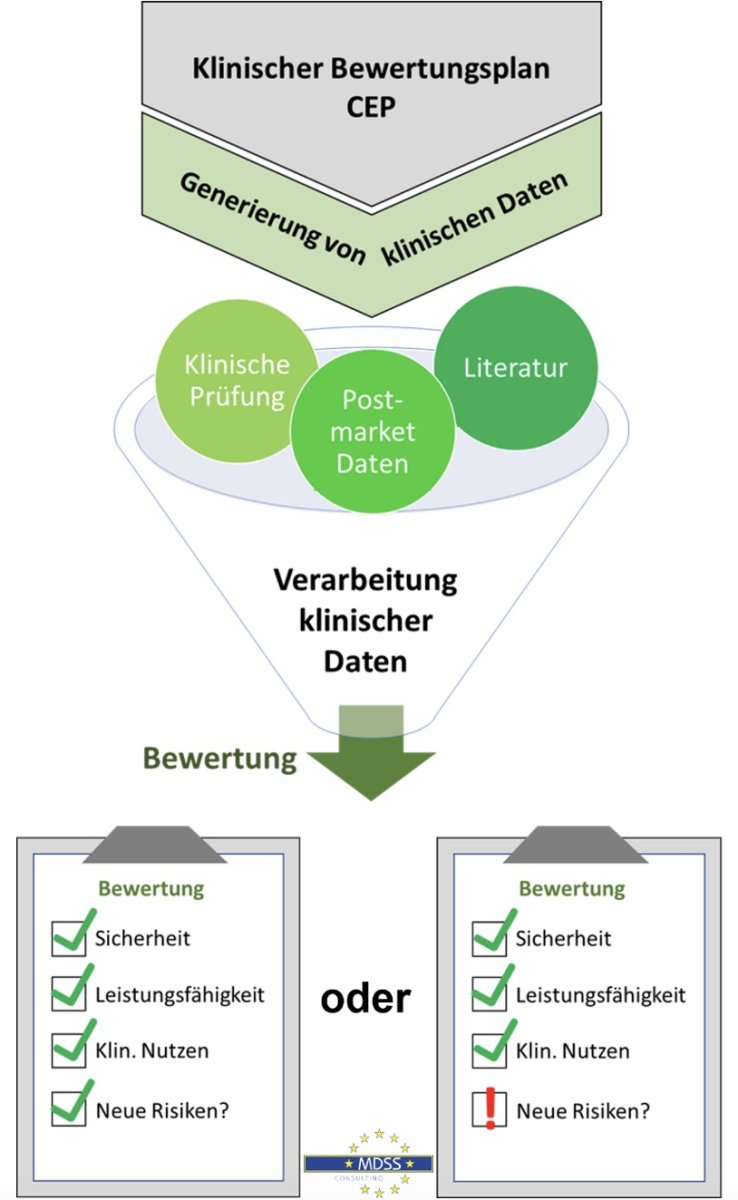
1. Wissenschaftliche Literatur
Die systematische Durchführung einer wissenschaftlichen Literatursuche ist ein sorgfältig geplanter Prozess, der nicht nur die Extraktion von Daten aus geeigneten Quellen und die Feststellung ihrer Relevanz für die klinische Bewertung umfasst, sondern auch eine kritische Bewertung der methodischen Qualität einschließt. Eine angemessene Gewichtung der Literatur ist ebenfalls erforderlich, um eine zuverlässige Evidenzbasis zu gewährleisten.
Mit der produktspezifischen wissenschaftlichen Literatursuche in medizinischen Fachjournalen (z.B. via PubMed, Embase und weiteren Datenbanken), Fachbüchern und Produktregistern können klinische Daten identifiziert werden. Diese Daten können das betrachtete Produkt, oder die als gleichartig/äquivalent nachgewiesenen Produkte betreffen.
2. Klinische Prüfungen
Die Notwendigkeit einer klinischen Prüfung wird üblicherweise während der klinischen Bewertung ermittelt. Wenn hierbei Defizite an klinischen Daten aufgedeckt werden, d.h. diese Daten nicht ausreichend vorhanden oder von unzureichender Qualität sind, müssen sie im Rahmen von klinischen Prüfungen gesammelt werden.
Die Auswahl des Typs der klinischen Prüfung ist im Wesentlichen abhängig davon, ob das Medizinprodukt eine CE-Kennzeichnung trägt, im Rahmen seiner Zweckbestimmung verwendet wird und ob zusätzliche invasive oder belastende Verfahren am Prüfungsteilnehmer angewendet werden sollen. Im Zuge des Konformitätsnachweises bzw. der weitergehenden Bewertung eines Produkts existieren prinzipiell zwei Arten von klinischen Prüfungen, für die die Anforderungen der Verordnung (EU) 2017/745 (MDR) gelten:
- Klinische Prüfungen gem. Art. 62
- PMCF-Studien gem. Art. 74
In der Abbildung ist der regulatorische Entscheidungsweg für entsprechende klinische Prüfungen dargestellt. Ob eine klinische Prüfung genehmigungs- bzw. meldepflichtig ist, ist abhängig von der der Art der klinischen Prüfung. Jede klinische Prüfung muss jedoch zumindest den anwendbaren Teilen der EN ISO 14155 sowie der DSGVO (Datenschutz-Grundverordnung) genügen und in den meisten Fällen eine Ethikkommission einbeziehen.
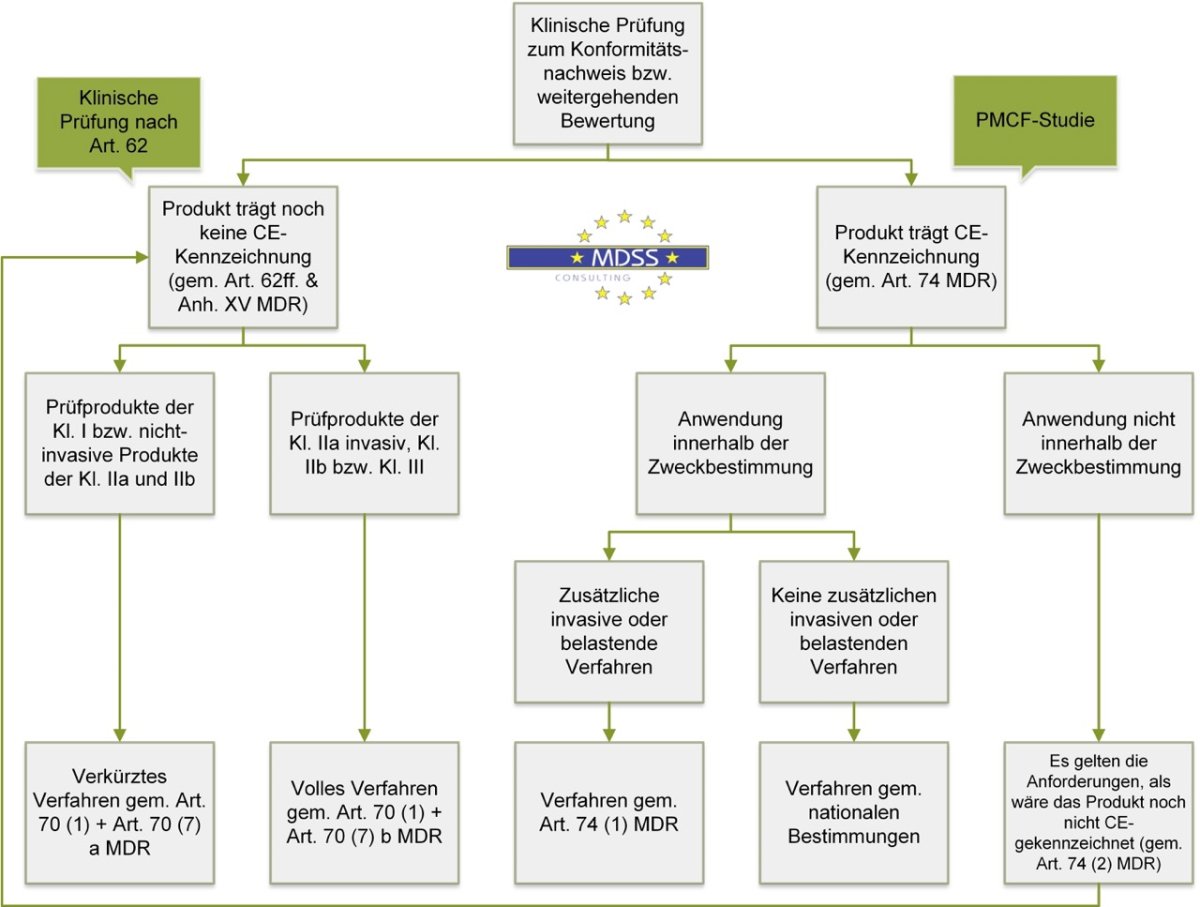
Abbildung: regulatorischer Entscheidungsweg für klinische Prüfungen zum Konformitätsnachweis bzw. weitergehenden Bewertung
3. Post-Market Daten via PMS
Sobald ein zugelassenes Medizinprodukt auf dem Unionsmarkt bereitgestellt und in der Praxis angewendet wird, können klinische Daten aus der Überwachung nach dem Inverkehrbringen (PMS, post-market surveillance), bzw. ggf. aus der klinischen Nachbeobachtung nach dem Inverkehrbringen (PMCF, post-market clinical follow-up), gesammelt werden. Das Durchführen von PMS ist obligatorisch, ob ein PMCF notwendig ist, ergibt sich aus der klinischen Bewertung. Zu den Tätigkeiten im Rahmen des PMS können z.B. gehören: die Bearbeitung von Reklamationen, Vigilanzaktivitäten, die Befragung von Patienten oder Anwendern, die Auswertung jeglicher Rückmeldungen, sowie die Recherche in Datenbanken von Überwachungsbehörden zu Vorkommnissen und Sicherheitskorrekturmaßnahmen im Feld von ähnlichen Produkten auf dem Markt. Darüber hinaus umfassen sie auch produktspezifische Maßnahmen im Rahmen des PMCF bis hin zu PMCF-Studien (s.o.). Die Erhebung von „real-world-data“ (= Daten aus dem klinischen Alltag) folgt dabei immer einem aktiven, kontinuierlichen und vor allem geplanten methodischen Vorgehen. Die Auswertung solcher klinischen Daten ermöglicht u.a., unterschätzte Komplikationen und Probleme, die vor der Markteinführung nicht erkannt wurden, sowie unvorhergesehenen Gebrauch eines Produkts während des gesamten Produktlebenszyklus zu identifizieren und zu beheben.
